
Az egyszerű műszaki kísérletek nagyon hasznosak a gyerekekkel, ez együtt töltik az időt, felkészítik a készségeket és a kis tervezők megértik az alapokat, hogy a kenyerek, mint a híres rajzfilmben, nem nőnek fákra.
Ezúttal úgy döntöttünk, hogy a legegyszerűbb kémiai áramforrást készítjük, és megpróbáljuk alkalmazni bármi praktikus célra. A gyakorlati alkalmazásról szólva érdemes emlékezni arra, hogy néhány generációval ezelőtt a rádióamatőröknek, akkumulátor rádióvevőik és erősítőik ellátására, felajánlottak többféle galvanikus elem vagy elem gyártását független gyártás céljából. Ezek az elemek Leklanshe és Popov [1] 9. ... 18. o., Vagy ólom-kálium-vagy gázakkumulátor [1], 22. ... 28. o. Számos, viszonylag nagy áramú elem csatlakozik egy izzító elemhez (rádiócsövek izzólámpa), tucatnyi kisebb elemhez egy anód elemhez, amelynek feszültsége elérheti a 60-80 voltot. Az akkumulátorok „nedvesek” voltak - folyékony elektrolittal voltak ellátva és karbantartást igényeltek.
Így galván cella, néhány szó "hogyan?" és "miért?" Elektromos áram akkor fordul elő, amikor a fémek kölcsönhatásba lépnek. Ebben az esetben más a potenciálkülönbség (feszültség). 1793-ban Alessandro Volta, galváncellát (Volta pólus) építve, meghatározta az akkor ismert fémek relatív aktivitását: Zn, Pb, Sn, Fe, Cu, Ag, Au. A galván cella "szilárdsága" annál nagyobb volt, minél távolabb álltak ebben a sorban a fémek (a feszültségek sorozata).

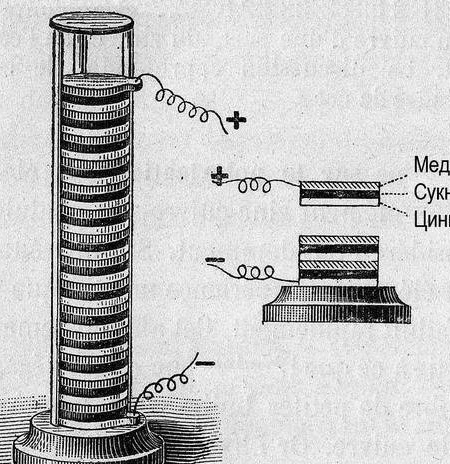
Később az adatok megszervezéséhez a „hidrogén elektróda” potenciálját nullára vettük referenciaértékre. A vele párosított fémek potenciáljának mérése után a kísérleti fémeket sorba rendeztük. Az eredményül kapott táblázatot "Fémfeszültségek elektrokémiai sorozatának" nevezték, és a kémiai szekrényben a periódusos rendszer és Dmitrij Ivanovics arcképe mellett kell lógnia.
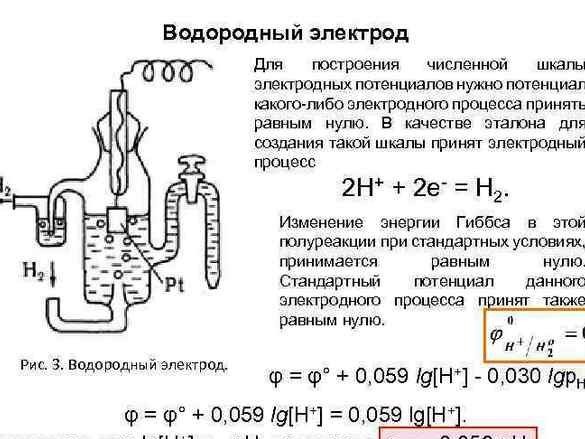

Számos fémfeszültség hasznos megoldás, a mi esetünkben, mint Alessandro Volta is, tudni fogjuk - minél jobban elválasztják a fémeket egymástól, annál nagyobb a feszültség.
Kísérleteinkben, a klasszikusokhoz hasonlóan, rézet és cinket használtunk.Amikor a lemezeket egy elektrolitba merítik, annak és a cinklemez között, kémiai reakció alakul ki, amelynek eredményeként negatív töltések halmozódnak fel a lemezen és negatív töltésűek. A galvanikus cellában zajló reakció eredményeként a cink-elektróda fokozatosan feloldódik.
A réz elektródán a galván cella működése közben apró hidrogénbuborékok képződnek, amelyek elkülönítik a réz felületét az elektrolittól. A jelenséget nevezik, egy galvanikus cellában káros, küzdenek vele. A felszabadult hidrogén eltávolításához hidrogénnek nevezett anyagokat vezetnek az elektrolitba. Szerepükben gyakran mangánvegyületek, réz-szulfát. Egyszerű kísérletekben gyógyszertári kálium-permanganát használható.
Amit használtunk a kísérlethez.
Készülékek és anyagok.
A galván cella összeállításához, mint réz elektródák, használhat huzalt, huzalt, fóliát. A cink extrahálható száraz elemekből, horganyzott termékek is felhasználhatók. Cink helyett megpróbálhat alumínium vagy vas elektródát használni. Nátrium-klorid elektrolithoz, egy kis puha rögzítőhuzal. Szüksége van egy voltmérőre vagy multiméterre, huzalvágókra, ollóra. Tartályként megfelelő méretű nemfém tartályok használhatók. Üveg, sokkal kényelmesebb, mint a könnyű műanyag poharak - nehezebbek, stabilabbak, nehezebb átütni. Nagyon jó, ha van alacsony áramerősségű alacsony feszültségű terhelés - egyszerű rádió, kvarcóra, stb.
"Nagyfeszültségű" akkumulátor huzalból és csavarokból.
A részletek egyszerűsége és a viszonylag magas feszültség lenyűgözve megpróbáltuk összeállítani egy ilyen akkumulátort. Itt egy „klasszikus” fémpár - réz-cink - kerül felhasználásra. Az ötlet az, hogy horganyzott kötőelemeket használjon cink elektródaként. Kecsesen. Nyilvánvaló, hogy egy ilyen elemet nem hosszú távú működésre tervezték - egy vékony cinkréteg gyorsan feloldódik, ez azonban nem fontos egy rövid távú kísérlethez. A horganyzott csavarok vagy fogaskerekek azonban mindenhol tele vannak.
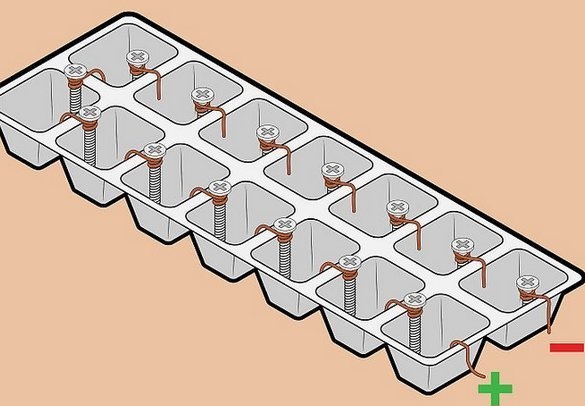
A vezetéket réz elektródaként is használják - ez szintén széles körben elérhető anyag, ráadásul - az elemek legkényelmesebb felszerelése az akkumulátorban - az összes elem sorba van kapcsolva - plusz egy a következő mínuszához. Ebben az esetben a feszültséget összegezzük, az áram változatlan marad.
Kezdjük!
Miután kiválasztottuk a kívánt hosszúságú horganyzott rögzítőelemek számát, megtaláltuk a megfelelő rézhuzalt. Ez egy tekercselő huzal lakk szigetelésnél. A huzal átmérője körülbelül 0,5 mm.

A rudazat többször megtisztítja a lakk szigetelését erőfeszítéssel, hogy a huzalt áthúzza egy közepes méretű, kétszeresen hajtogatott csiszolóhéjon.


Ezután előállít egy pár elektródát - egy öncsavar csavarja alá, szorosan körülteszi a huzal két vagy három fordulatát, és levágja a felesleget.

Akkumulátor összeszerelése - egy vályút használtak konténerként a jég fagyasztására. Használhatja a dobozos édességekből származó sejteket, ám ezek finomabbak. Miután az elektródokat a cellák közötti falra szerelte, megtöltjük az edényeket elektrolittal. Az asztali só oldatát használtuk - egy evőkanálra 0,5 liter meleg vízzel. Töltéséhez nagyon kényelmes orvosi fecskendőt használni.


Találtunk még néhány csavart az elektródákhoz és hozzáadott elemeket az akkumulátorhoz. A nagy impedanciájú terhelésnél (a digitális voltmérő bemeneti ellenállása) a feszültség jelentős, de bármilyen terhelésnél, bármennyire észrevehető is, jelentősen csökken.
Próbáld megtenni hasonló galván cella (elem) nagyobb elektródákkal.
Konténerként fél literes üveget (kettőt) használtunk, egy jelentős területű tálcák beleférnek benne. Elektródákként vékony rézfóliát és cinket vettünk - egy üveg maradványait egy gyári "száraz" elemből, amelyet szétszereltek a grafit előállítása során tűzálló bevonat.

Megtisztítottuk a szárított kristályos sók maradványait drótkefével és kb. Ollóval két lemezt levágtunk, körülbelül azonos területtel. Rézfóliából vágjon le két megfelelő csíkot. Ollóval is. Két pár elektródot kaptunk, amelyek felszerelésük nélkül, az elemek szélesebb hajlítása nélkül, a doboz nyakán hajlították meg az elemeinket.


Nagyobb edényben elektrolit-nátrium-kloridot készítettek, meleg vízben feloldva, a koncentráció megegyezik, és az elkészített elemeket öntik.


A két elemet sorba kötöttük egy darab rögzítőhuzal és két krokodilkapocs segítségével. Tehát rendben van, az akkumulátor feszültsége közel van a szokásos "ujjhoz", próbálja meg használni. Az elemet 1,5 V feszültséggel használják egy elektromechanikus órában, emellett az óra áramfogyasztása nagyon kicsi, és az akkumulátorunk képes lesz túlterhelni.

Kivettük a normál akkumulátort az óráról, és a rögzítőhuzal egy darabját csatlakoztattuk a csatlakozókhoz. Figyelembe véve a polaritást (rézlemez - "+", cink - "-"), csatlakoztattuk az órát az akkumulátorhoz, voila! Az óra működik, a feszültség "1,3" -ra "süllyed". Az óra több órán át tökéletesen működött, amíg mindannyian dicsekedtünk (bár varázsló!), Majd belefáradtunk.

A pályára.
Bármely gyermek belső felépítése olyan, hogy a figyelem egy témára összpontosít, legfeljebb 15 ... 20 percet tud összpontosítani, és a gyermekekkel folytatott összes órát úgy kell megtervezni, hogy abban az időben beleférjen, vagy váltson a különböző osztályok között, különben mindkettő szenvedni fog.
Terhelésként jobb, ha alkalmazzuk, függetlenül attól, hogy mozgó vagy világító - a voltmérőn megjelenő számok az elmere hatnak, de nem a szívre. Az órák és a számológépek mellett minden bizonnyal csodálatot fog okozni, egy kis rádióvevő házi készítésű eleméből származó munkát (opcionálisan - házi készítésű!).
Hosszú távú alkalmazás esetén a cellák elektrolitját meg kell védeni a portól és a párolgástól, és ügyelni kell a depolarizátorra - nos, legalább eltömve az üveget egy rugalmas szalaggal ellátott műanyag fóliával, és kálium-permanganátot adva az elektrolithoz. Sőt, jobb, ha azonnal összegyűjti a Popov említett elemet.
A horganyzott önmetsző csavarok mellett horganyzott acéllemez is használható, nagy elemeknél sokkal kényelmesebb - a kísérlet során bármilyen jelentős áramot és energiát kaphat (ujjait a levegőben mozgatva).
A felhasznált irodalom felsorolása.
1. P. Strelkov. Tudd és tudd. Pioneer villamosmérnök. Detgiz. 1960 év
2. Polosin V. S., Prokopenko V. G. Műhely a kémia tanításának módszertanáról. Moszkva, "Megvilágosodás", 1989, 202., 203. oldal.

